6.2.3 参考文献(略)







2Z5帝国网站管理系统 6.2.32Z5帝国网站管理系统 放射治疗2Z5帝国网站管理系统 参考文献(略)2Z5帝国网站管理系统 2Z5帝国网站管理系统
 2Z5帝国网站管理系统
2Z5帝国网站管理系统
 2Z5帝国网站管理系统
2Z5帝国网站管理系统 2Z5帝国网站管理系统
2Z5帝国网站管理系统
 2Z5帝国网站管理系统
2Z5帝国网站管理系统 2Z5帝国网站管理系统
2Z5帝国网站管理系统 2Z5帝国网站管理系统
2Z5帝国网站管理系统 2Z5帝国网站管理系统
2Z5帝国网站管理系统
 【解读】中国前列腺癌放射治疗(2020年版)
【解读】中国前列腺癌放射治疗(2020年版)
 2024 EAU前列腺癌指南-第6章前列腺癌的治疗-治疗方式-前列腺癌放...
2024 EAU前列腺癌指南-第6章前列腺癌的治疗-治疗方式-前列腺癌放...
 【共识】前列腺癌放射治疗安全共识
【共识】前列腺癌放射治疗安全共识
 【解读】前列腺癌根治性手术后生化复发挽救性治疗:AUA/ASTRO/SUO...
【解读】前列腺癌根治性手术后生化复发挽救性治疗:AUA/ASTRO/SUO...
 根治性前列腺切除术后生化复发的高危患者诊治共识(2024年版)...
根治性前列腺切除术后生化复发的高危患者诊治共识(2024年版)...
 2024 EAU前列腺癌指南-第6章前列腺癌的治疗-治疗方式-根治性前列...
2024 EAU前列腺癌指南-第6章前列腺癌的治疗-治疗方式-根治性前列...
 高危前列腺癌围手术期综合治疗专家共识(2023年版)...
高危前列腺癌围手术期综合治疗专家共识(2023年版)...
其他热门专题
 前列腺癌放疗,那些你想知道的事
前列腺癌放疗,那些你想知道的事
 前列腺癌的根治性治疗除了手术外还有放疗,你知道吗?...
前列腺癌的根治性治疗除了手术外还有放疗,你知道吗?...
 前列腺癌的放射治疗
前列腺癌的放射治疗
 NEJM:长达15年的研究显示,确诊局限期前列腺癌后或无需立即手术或放...
NEJM:长达15年的研究显示,确诊局限期前列腺癌后或无需立即手术或放...
 前列腺癌手术:传统开腹手术和腹腔镜手术,哪个更强?...
前列腺癌手术:传统开腹手术和腹腔镜手术,哪个更强?...
 JAMA综述丨前列癌术后诊断及治疗进展
JAMA综述丨前列癌术后诊断及治疗进展
 年轻前列腺癌患者质子治疗后对性健康影响的长期疗效研究...
年轻前列腺癌患者质子治疗后对性健康影响的长期疗效研究...
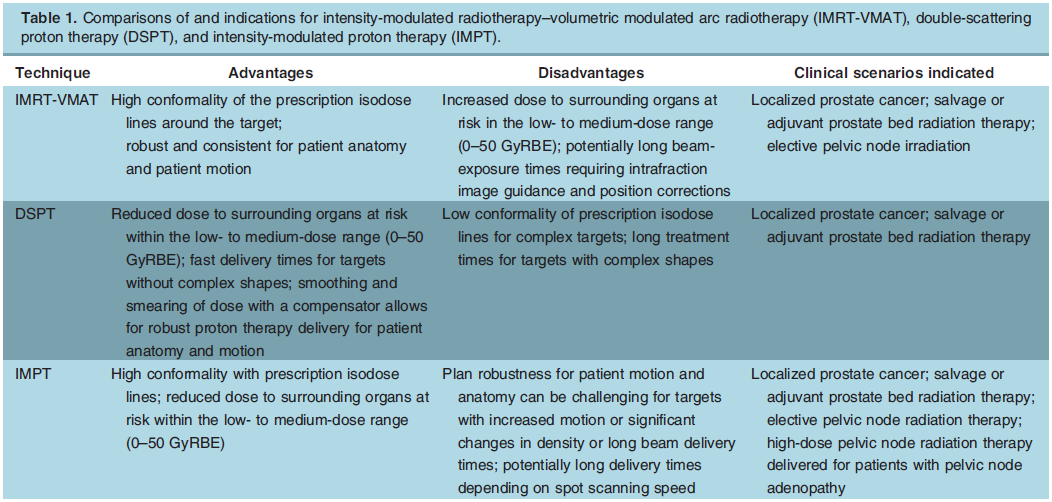 前列腺癌质子治疗共识声明
前列腺癌质子治疗共识声明
 前列腺癌质子重离子治疗简介
前列腺癌质子重离子治疗简介
其他热门专题
 前列腺癌化疗期间患者需要知道哪些事儿?
前列腺癌化疗期间患者需要知道哪些事儿?
 前列腺癌新辅助治疗安全共识
前列腺癌新辅助治疗安全共识
 雄激素剥夺疗法(ADT)不良反应的管理措施
雄激素剥夺疗法(ADT)不良反应的管理措施
 前列腺治疗后尿失禁:2024 AUA/GURS/SUFU指南解读
前列腺治疗后尿失禁:2024 AUA/GURS/SUFU指南解读
 前列腺癌药物去势治疗随访管理中国专家共识(2024版)...
前列腺癌药物去势治疗随访管理中国专家共识(2024版)...
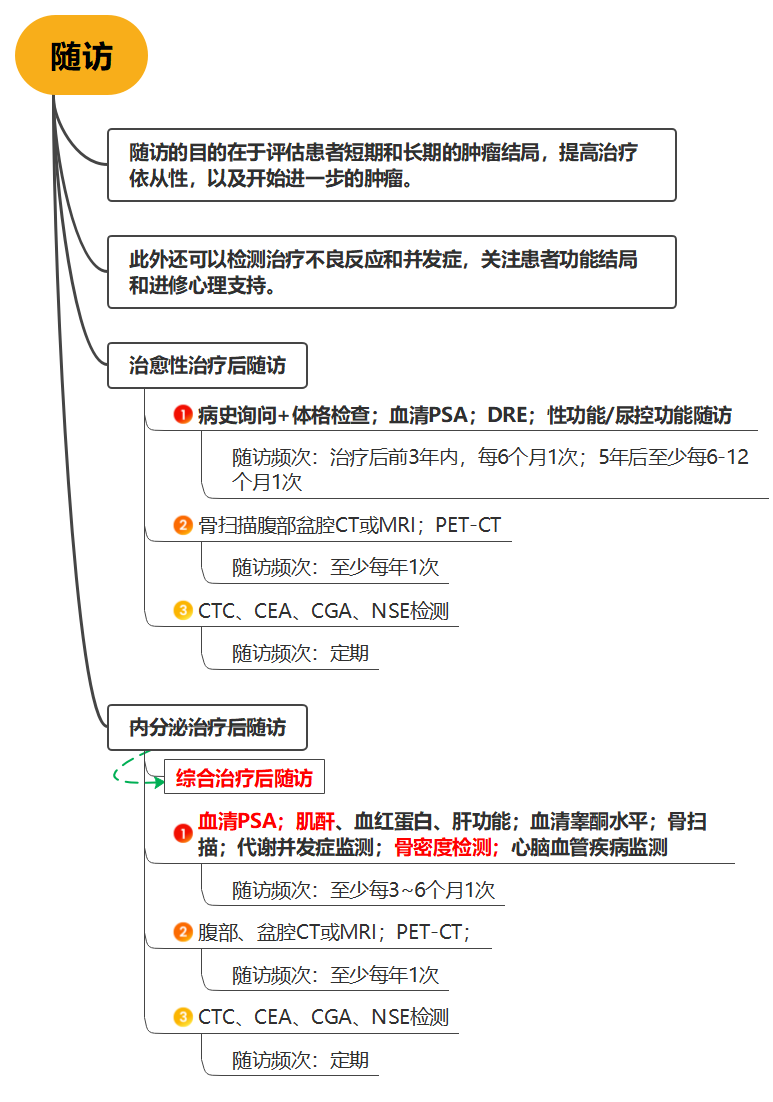 前列腺癌要如何随访/CSCO指南
前列腺癌要如何随访/CSCO指南
 前列腺癌术后可否洗澡?饮食该注意什么?一文让你秒懂!...
前列腺癌术后可否洗澡?饮食该注意什么?一文让你秒懂!...
 前列腺癌患者能不能吃红菜头?
前列腺癌患者能不能吃红菜头?
 科学饮食,改善前列腺癌结局
科学饮食,改善前列腺癌结局
 惊了!靠补维生素D可以逆转早期前列腺癌?
惊了!靠补维生素D可以逆转早期前列腺癌?
其他前列腺癌护理专题
 这病瞒不了!磁共振比你更懂!
这病瞒不了!磁共振比你更懂!
 为什么要做前列腺磁共振检查?
为什么要做前列腺磁共振检查?
 增强超声和磁共振成像在前列腺癌中的诊断价值研究...
增强超声和磁共振成像在前列腺癌中的诊断价值研究...
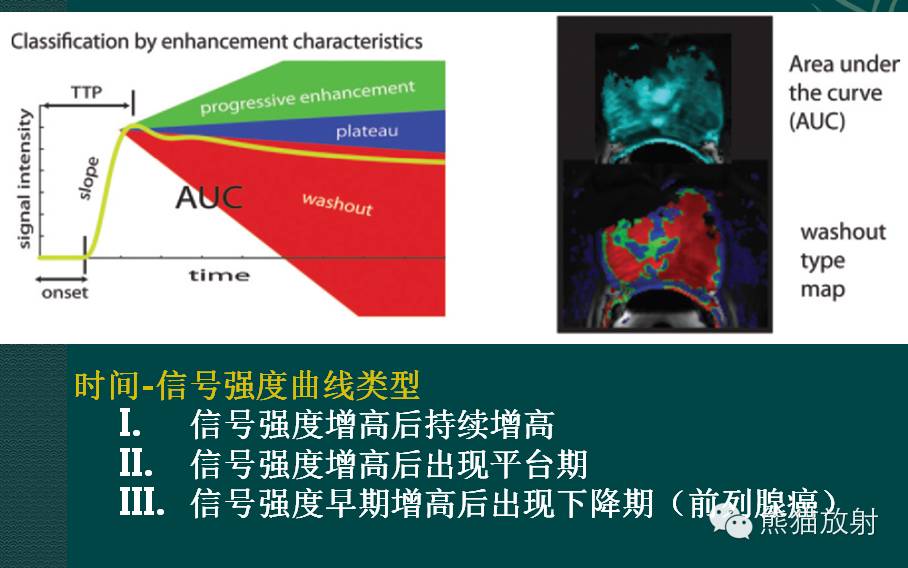 前列腺癌的MRI表现
前列腺癌的MRI表现
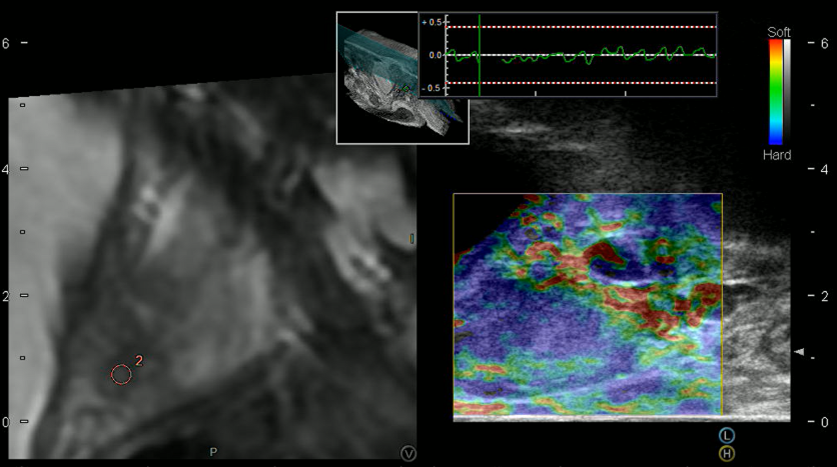 磁共振-超声融合引导下前列腺穿刺活检——可视化、系统化、客制...
磁共振-超声融合引导下前列腺穿刺活检——可视化、系统化、客制...
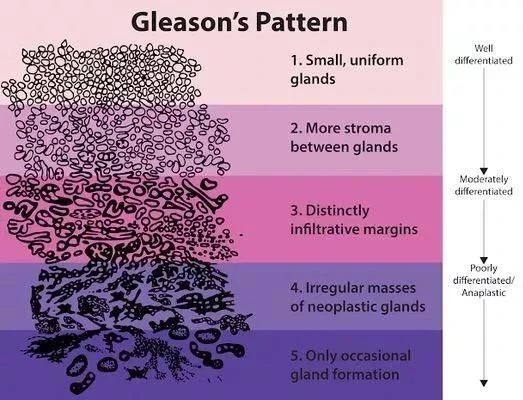 完前列腺穿刺,病理报告要怎么看?
完前列腺穿刺,病理报告要怎么看?
 前列腺靶向穿刺活检新进展
前列腺靶向穿刺活检新进展
 2024版EAU指南 | 前列腺癌诊断性评价 活检方法
2024版EAU指南 | 前列腺癌诊断性评价 活检方法
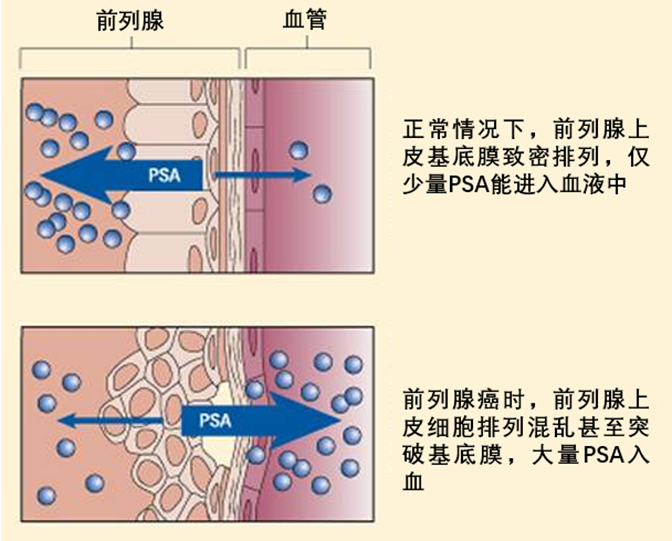 前列腺特异抗原(PSA)到底是个啥
前列腺特异抗原(PSA)到底是个啥
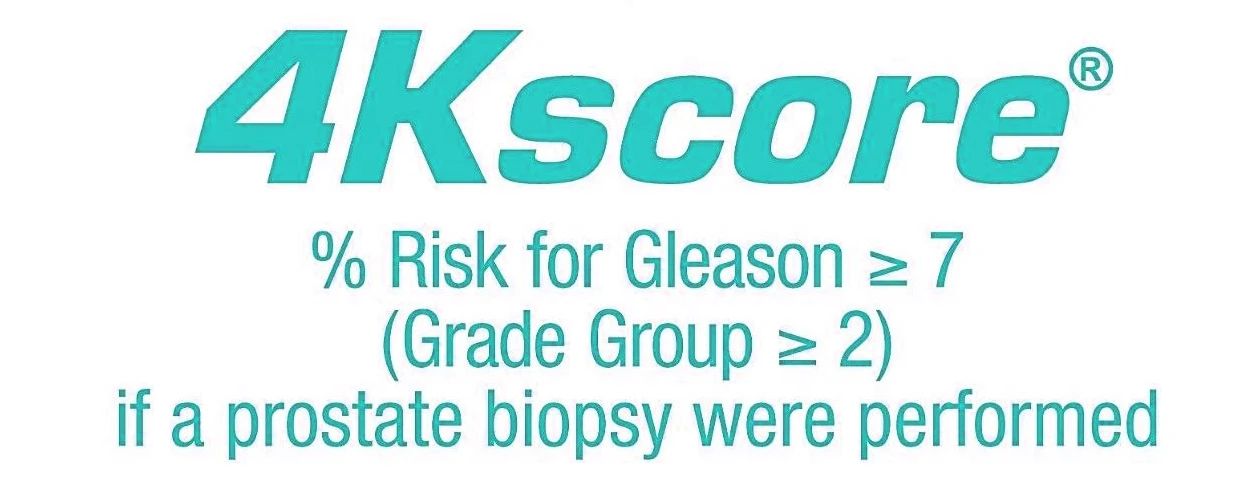 前列腺癌早知道:肿瘤标志物与早期筛查
前列腺癌早知道:肿瘤标志物与早期筛查
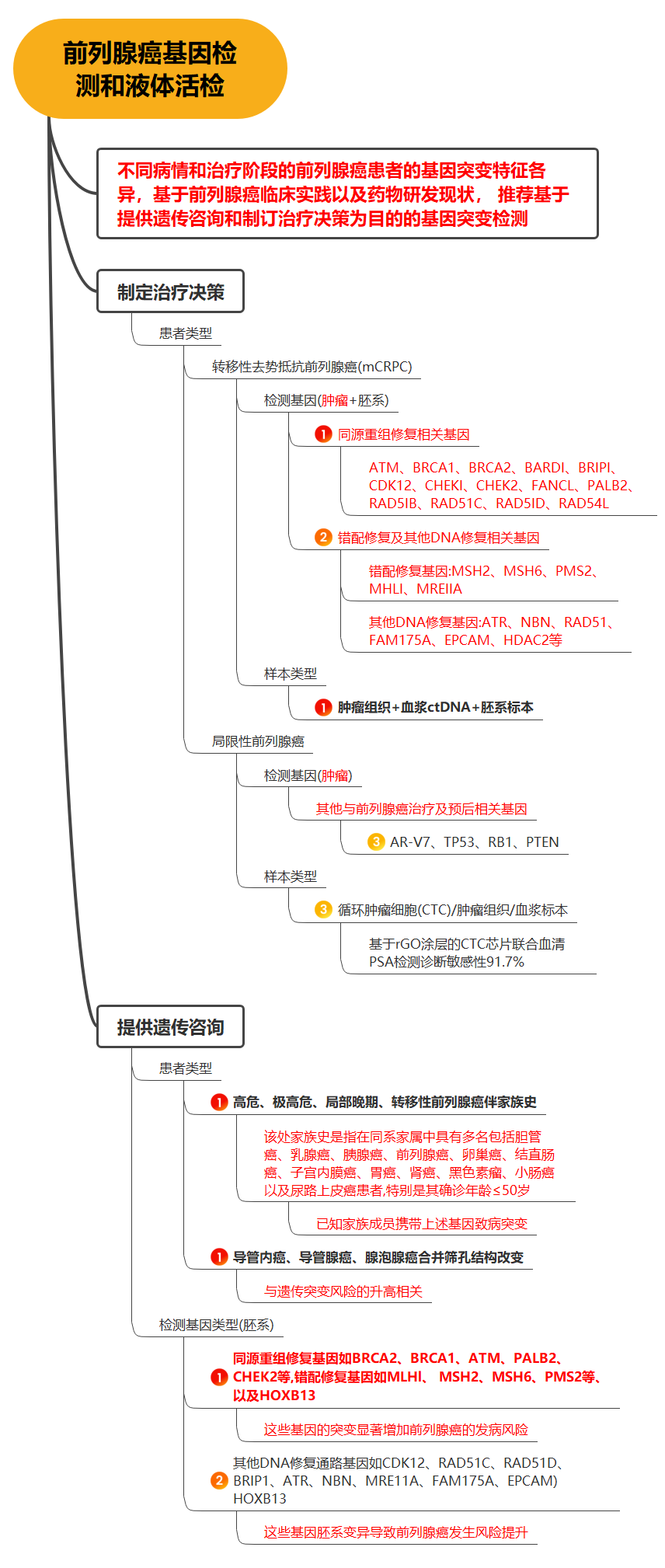 一图看懂CSCO前列腺癌指南:基因检测和液体活检...
一图看懂CSCO前列腺癌指南:基因检测和液体活检...
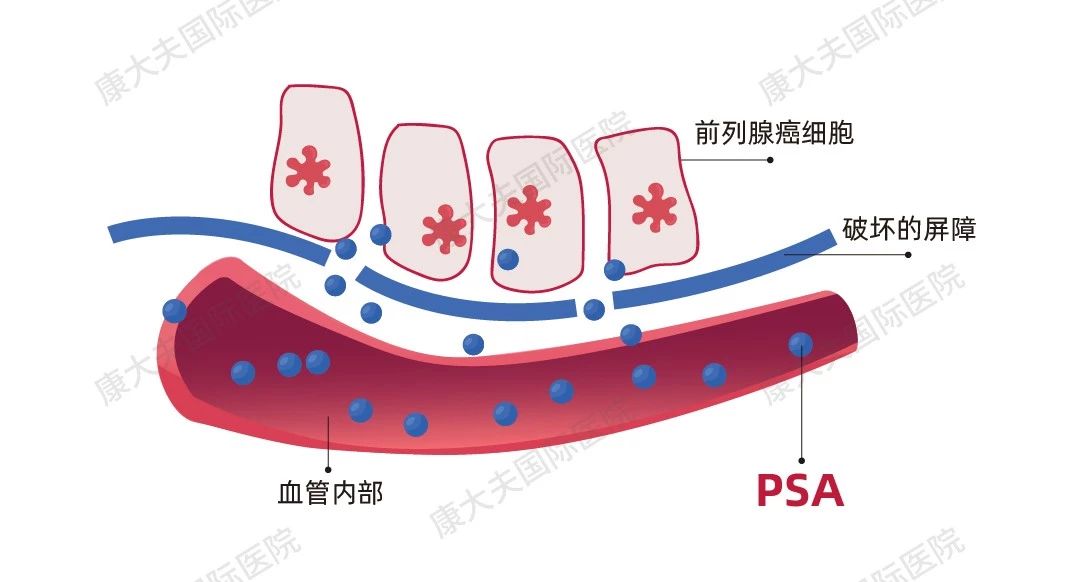 同是PSA升高为什么一个是癌,一个是炎症?
同是PSA升高为什么一个是癌,一个是炎症?
 前列腺癌会出现哪些预兆和症状?
前列腺癌会出现哪些预兆和症状?
 前列腺增生会转变为前列腺癌吗?
前列腺增生会转变为前列腺癌吗?
 科普 |七种征兆,敲响前列腺癌风险警钟
科普 |七种征兆,敲响前列腺癌风险警钟
 前列腺增生不治会变癌?这是没必要的担心
前列腺增生不治会变癌?这是没必要的担心
其他诊断筛查专题
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 南京鼓楼医院
南京
南京鼓楼医院
南京
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 南京市胸科医院
南京
南京市胸科医院
南京
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 新桥医院
重庆
新桥医院
重庆
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 南京市胸科医院
南京
南京市胸科医院
南京
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 西南医院
重庆
西南医院
重庆
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 北部战区总医院
沈阳
北部战区总医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 上海长征医院
上海
上海长征医院
上海
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 新桥医院
重庆
新桥医院
重庆
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 301医院
北京
301医院
北京
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 浙大二院
杭州
浙大二院
杭州
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 上海市东方医院
上海
上海市东方医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 新桥医院
重庆
新桥医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 301医院
北京
301医院
北京
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 上海长海医院
上海
上海长海医院
上海
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 西南医院
重庆
西南医院
重庆
 南京市胸科医院
南京
南京市胸科医院
南京
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 西安交通大学第一附属医院
西安
西安交通大学第一附属医院
西安
第63名 综合排名
 中国科学技术大学附属第一医院
合肥
中国科学技术大学附属第一医院
合肥
第95名 综合排名
 山东大学齐鲁医院
济南
山东大学齐鲁医院
济南
第24名 综合排名
 吉林省肿瘤医院
长春
吉林省肿瘤医院
长春
 辽宁省肿瘤医院
沈阳
辽宁省肿瘤医院
沈阳
 山西省肿瘤医院
太原
山西省肿瘤医院
太原
 新桥医院
重庆
新桥医院
重庆
 浙江大学医学院附属妇产科医院
杭州
浙江大学医学院附属妇产科医院
杭州
第91名 综合排名
 北部战区总医院
沈阳
北部战区总医院
沈阳
 深圳市第三人民医院
深圳
深圳市第三人民医院
深圳
 杭州市肿瘤医院
杭州
杭州市肿瘤医院
杭州
 南京市胸科医院
南京
南京市胸科医院
南京
 中日友好医院
北京
中日友好医院
北京
第43名 综合排名
 福建省肿瘤医院
福州
福建省肿瘤医院
福州
 广东省人民医院
广州
广东省人民医院
广州
第34名 综合排名
 四川省肿瘤医院
成都
四川省肿瘤医院
成都
 中山大学附属第三医院
广州
中山大学附属第三医院
广州
第45名 综合排名
 上海美中嘉和肿瘤门诊部
上海
上海美中嘉和肿瘤门诊部
上海
 中山大学附属第六医院
广州
中山大学附属第六医院
广州
 西南医院
重庆
西南医院
重庆
 福建医科大学附属第一医院
福州
福建医科大学附属第一医院
福州
第84名 综合排名
 哈尔滨医科大学附属第一医院
哈尔滨
哈尔滨医科大学附属第一医院
哈尔滨
第78名 综合排名
 兰州大学第二医院
兰州
兰州大学第二医院
兰州
 四川大学华西第二医院
成都
四川大学华西第二医院
成都
第70名 综合排名
 广东省中医院
广州
广东省中医院
广州
 山东省立医院
济南
山东省立医院
济南
第52名 综合排名
 上海长征医院
上海
上海长征医院
上海
 厦门大学附属第一医院
厦门
厦门大学附属第一医院
厦门
 南京鼓楼医院
南京
南京鼓楼医院
南京
 中国科大附一院
安徽
中国科大附一院
安徽
 山东省公共卫生临床中心
济南
山东省公共卫生临床中心
济南
 重庆医科大学附属第一医院
重庆
重庆医科大学附属第一医院
重庆
第48名 综合排名
 武汉大学中南医院
武汉
武汉大学中南医院
武汉
第55名 综合排名
 中南大学湘雅二医院
长沙
中南大学湘雅二医院
长沙
第20名 综合排名
 上海市肺科医院
上海
上海市肺科医院
上海
第42名 综合排名
 吉林大学白求恩第一医院
长春
吉林大学白求恩第一医院
长春
 东部战区总医院
南京
东部战区总医院
南京
第58名 综合排名
 中山大学孙逸仙纪念医院
广州
中山大学孙逸仙纪念医院
广州
第64名 综合排名
 东南大学附属中大医院
南京
东南大学附属中大医院
南京
第46名 综合排名
 301医院
北京
301医院
北京
 四川省人民医院
成都
四川省人民医院
成都
第38名 综合排名
 哈尔滨医科大学附属第二医院
哈尔滨
哈尔滨医科大学附属第二医院
哈尔滨
第67名 综合排名
 福建医科大学附属协和医院
福州
福建医科大学附属协和医院
福州
第88名 综合排名
 广州医科大学附属第一医院
广州
广州医科大学附属第一医院
广州
第31名 综合排名
 复旦大学附属妇产科医院
上海
复旦大学附属妇产科医院
上海
第85名 综合排名
 重庆大学附属肿瘤医院
重庆
重庆大学附属肿瘤医院
重庆
 中山大学附属肿瘤医院
广州
中山大学附属肿瘤医院
广州
 上海市第十人民医院
上海
上海市第十人民医院
上海
 中南大学湘雅医院
长沙
中南大学湘雅医院
长沙
第15名 综合排名
 复旦大学附属中山医院
上海
复旦大学附属中山医院
上海
第5名 综合排名
 华中科技大学同济医院
武汉
华中科技大学同济医院
武汉
 北京医院
北京
北京医院
北京
第60名 综合排名
 上海交通大学医学院附属仁济医院
上海
上海交通大学医学院附属仁济医院
上海
第17名 综合排名
 浙江省肿瘤医院
杭州
浙江省肿瘤医院
杭州
第8名 肿瘤科排名
 北京京西肿瘤医院
北京
北京京西肿瘤医院
北京
 上海交通大学医学院附属瑞金医院
上海
上海交通大学医学院附属瑞金医院
上海
第4名 综合排名
 上海市胸科医院
上海
上海市胸科医院
上海
第80名 综合排名
 湖南省肿瘤医院
长沙
湖南省肿瘤医院
长沙
 上海新华医院
上海
上海新华医院
上海
 江苏省肿瘤医院
南京
江苏省肿瘤医院
南京
第9名 肿瘤科排名
 中山大学附属第一医院
广州
中山大学附属第一医院
广州
第9名 综合排名
 南方医科大学南方医院
广州
南方医科大学南方医院
广州
第18名 综合排名
 上海市东方医院
上海
上海市东方医院
上海
 浙大二院
杭州
浙大二院
杭州
 浙江大学医学院附属第一医院
杭州
浙江大学医学院附属第一医院
杭州
第10名 综合排名
 湖北省肿瘤医院
武汉
湖北省肿瘤医院
武汉
 北京大学第一医院
北京
北京大学第一医院
北京
第12名 综合排名
 河南省肿瘤医院
郑州
河南省肿瘤医院
郑州
 苏州大学附属第一医院
苏州
苏州大学附属第一医院
苏州
第54名 综合排名
 武汉大学人民医院
武汉
武汉大学人民医院
武汉
第40名 综合排名
 中国医科大学附属盛京医院
沈阳
中国医科大学附属盛京医院
沈阳
第33名 综合排名
 中国医科大学附属第一医院
沈阳
中国医科大学附属第一医院
沈阳
第16名 综合排名
 上海东方肝胆外科医院
上海
上海东方肝胆外科医院
上海
 浙江大学医学院附属邵逸夫医院
杭州
浙江大学医学院附属邵逸夫医院
杭州
第49名 综合排名
 复旦大学附属华山医院
上海
复旦大学附属华山医院
上海
第8名 综合排名
 广州泰和肿瘤医院
广州
广州泰和肿瘤医院
广州
 云南省肿瘤医院
昆明
云南省肿瘤医院
昆明
 北京胸科医院
北京
北京胸科医院
北京
第100名 综合排名
 上海长海医院
上海
上海长海医院
上海
 中山大学附属第五医院
珠海
中山大学附属第五医院
珠海
 哈尔滨医科大学附属肿瘤医院
哈尔滨
哈尔滨医科大学附属肿瘤医院
哈尔滨
 北京大学人民医院
北京
北京大学人民医院
北京
第21名 综合排名
 上海市质子重离子医院
上海
上海市质子重离子医院
上海
 CSCO前列腺癌指南更新!瑞维鲁胺治疗高瘤负荷mHSPC获首位推荐!...
CSCO前列腺癌指南更新!瑞维鲁胺治疗高瘤负荷mHSPC获首位推荐!...
 拜耳darolutamide作为男性非转移性去势抵抗前列腺癌的新型疗法在...
拜耳darolutamide作为男性非转移性去势抵抗前列腺癌的新型疗法在...
 Darolutamide获美国FDA批准,治疗男性非转移性去势抵抗性前列腺癌...
Darolutamide获美国FDA批准,治疗男性非转移性去势抵抗性前列腺癌...
 FDA批准尼拉帕利和醋酸阿比特龙双效药物联合泼尼松用于治疗BRCA...
FDA批准尼拉帕利和醋酸阿比特龙双效药物联合泼尼松用于治疗BRCA...
 国家食品药品监督管理总局批准泽珂用于治疗转移性去势抵抗性前列...
国家食品药品监督管理总局批准泽珂用于治疗转移性去势抵抗性前列...
 前列腺癌新药!强生阿帕他胺(Erleada)获FDA批准治疗去势敏感性前列...
前列腺癌新药!强生阿帕他胺(Erleada)获FDA批准治疗去势敏感性前列...
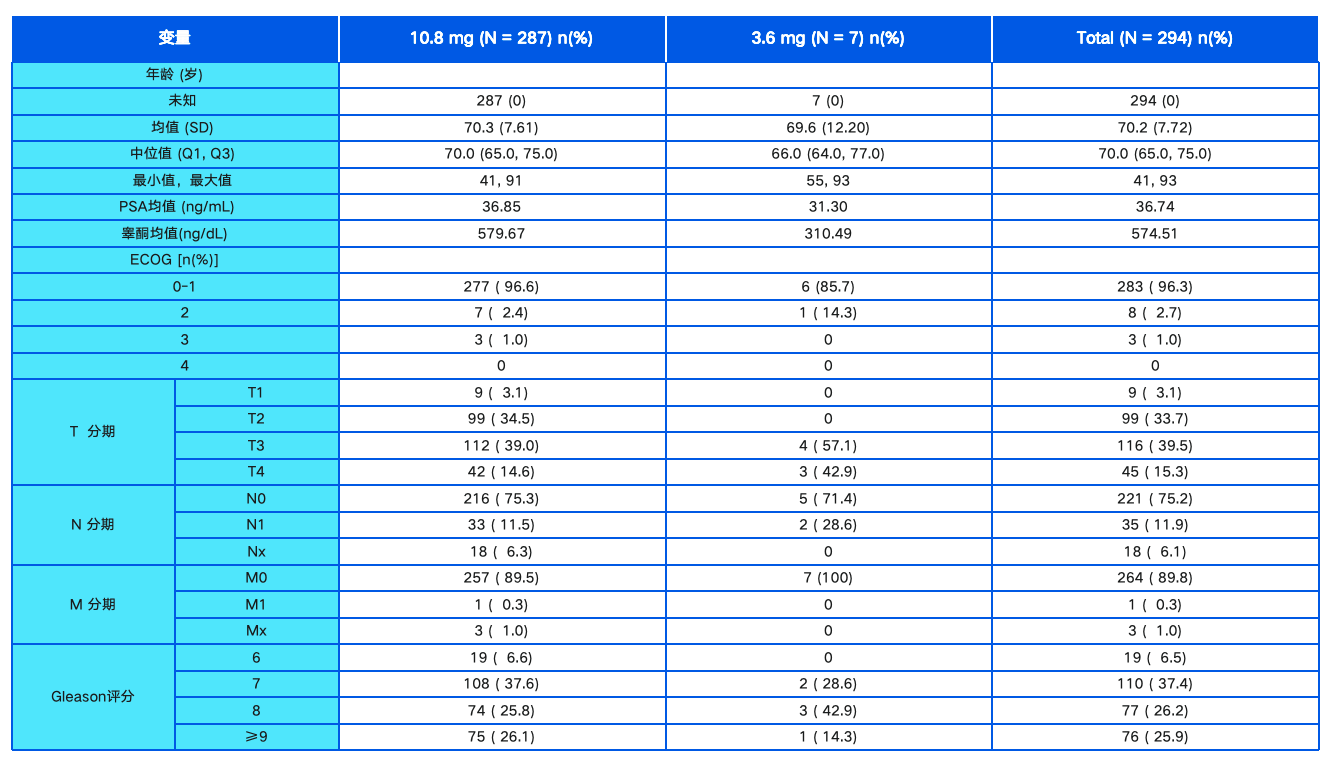 高效去势,长期维持,安全可靠 | 中国前列腺癌最大样本量真实世界研...
高效去势,长期维持,安全可靠 | 中国前列腺癌最大样本量真实世界研...
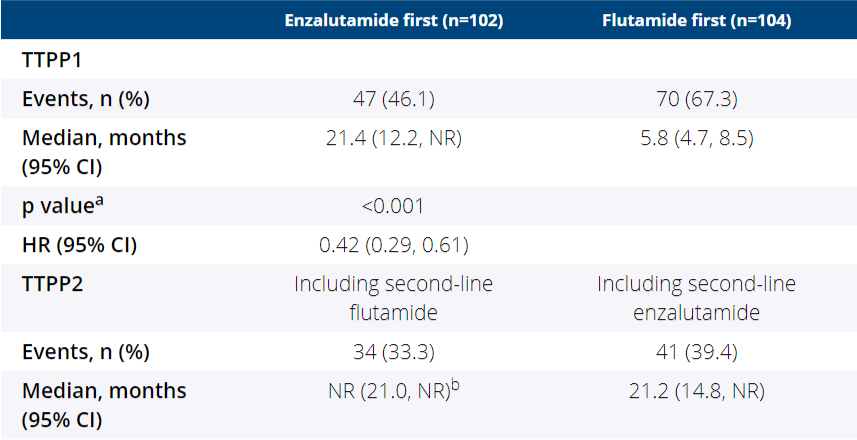 新型抗雄药的“大满贯”——专家解析恩扎卢胺的研究进展和实践经...
新型抗雄药的“大满贯”——专家解析恩扎卢胺的研究进展和实践经...
 LANCET ONCOL:晚期前列腺癌的新方案
LANCET ONCOL:晚期前列腺癌的新方案
 蔡燚博士 | 负“肿”而行:回顾来时路,在前列腺癌领域发出自己的声...
蔡燚博士 | 负“肿”而行:回顾来时路,在前列腺癌领域发出自己的声...
 叶定伟教授、张健教授:从临床和药学角度看前列腺癌内分泌治疗...
叶定伟教授、张健教授:从临床和药学角度看前列腺癌内分泌治疗...
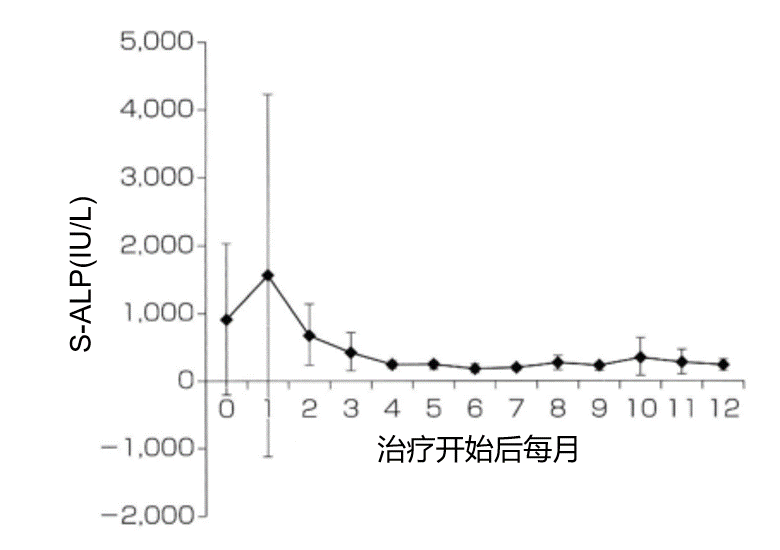 探泌之“地”丨郭刚教授解析前列腺癌骨转移的诊疗进展...
探泌之“地”丨郭刚教授解析前列腺癌骨转移的诊疗进展...
搜索结果
前列腺癌药物分类
 要年龄足够大,每个男性最终都会得前列腺癌?前列腺癌这3大高危因素...
要年龄足够大,每个男性最终都会得前列腺癌?前列腺癌这3大高危因素...
 前列腺癌的病因是什么?
前列腺癌的病因是什么?
 尿频、尿痛确诊前列腺癌?前列腺癌如何预防?康康漫画科普⑤...
尿频、尿痛确诊前列腺癌?前列腺癌如何预防?康康漫画科普⑤...
 前列腺癌真的是“惰性癌”吗?
前列腺癌真的是“惰性癌”吗?
 前列腺癌有“惰性”?
前列腺癌有“惰性”?
 爸气十足 一往无前丨知否?这种前列腺癌治后皆可长期生存...
爸气十足 一往无前丨知否?这种前列腺癌治后皆可长期生存...
 前列腺癌并不可怕,早期发现治愈率很高!
前列腺癌并不可怕,早期发现治愈率很高!
其他热门专题
 前列腺癌骨转移介绍
前列腺癌骨转移介绍
 循证为本,有据可依——前列腺癌骨转移诊疗现状...
循证为本,有据可依——前列腺癌骨转移诊疗现状...
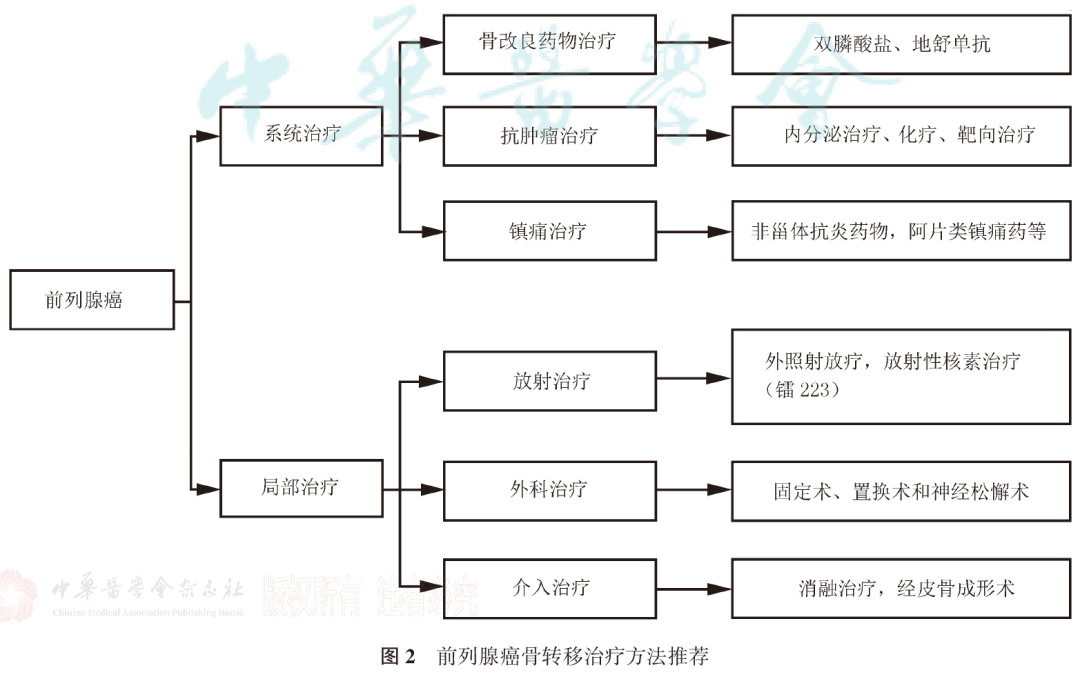 前列腺癌骨转移和骨相关疾病临床诊疗专家共识(2021版)...
前列腺癌骨转移和骨相关疾病临床诊疗专家共识(2021版)...
 前列腺癌根治性切除后,PSA一定都测量不到吗?...
前列腺癌根治性切除后,PSA一定都测量不到吗?...
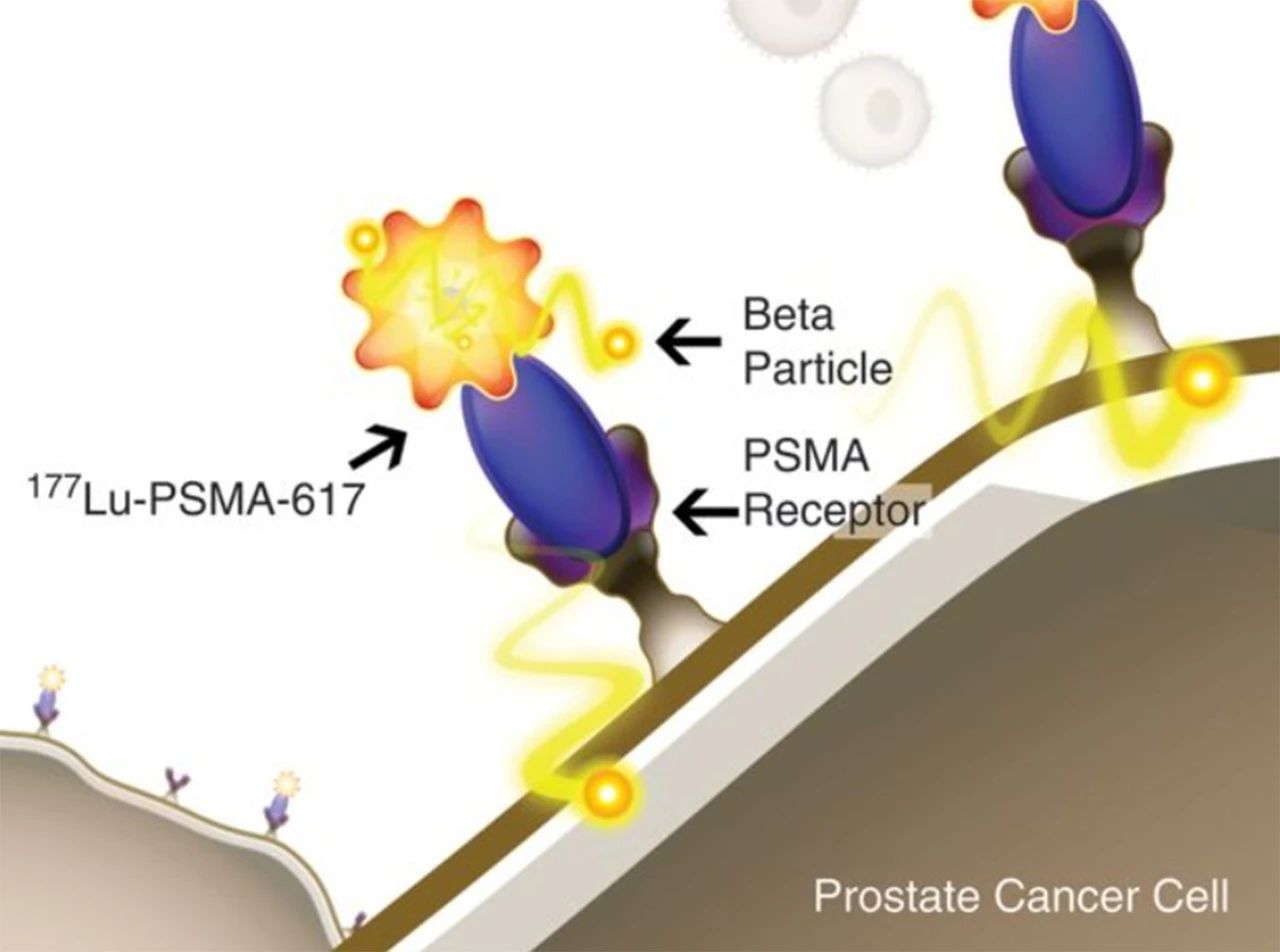 前列腺癌骨转移可以放疗或手术吗?
前列腺癌骨转移可以放疗或手术吗?
 前列腺癌挽救性治疗:AUA/ASTRO/SUO指南(2024版)...
前列腺癌挽救性治疗:AUA/ASTRO/SUO指南(2024版)...
 治愈性治疗后复发前列腺癌的治疗/CSSO指南
治愈性治疗后复发前列腺癌的治疗/CSSO指南
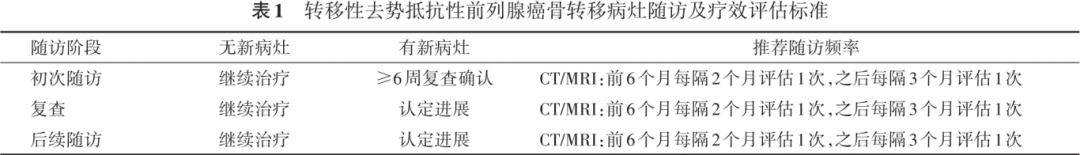 前列腺癌药物去势治疗随访管理中国专家共识(2024版)...
前列腺癌药物去势治疗随访管理中国专家共识(2024版)...
 前列腺癌骨转移有药吃吗?
前列腺癌骨转移有药吃吗?
其他热门专题
 实锤来了,肉酒模式和甜食模式会大幅度提高前列腺癌发病和转移风险...
实锤来了,肉酒模式和甜食模式会大幅度提高前列腺癌发病和转移风险...
 男性每天多喝一杯咖啡,可以降低前列腺癌风险!...
男性每天多喝一杯咖啡,可以降低前列腺癌风险!...
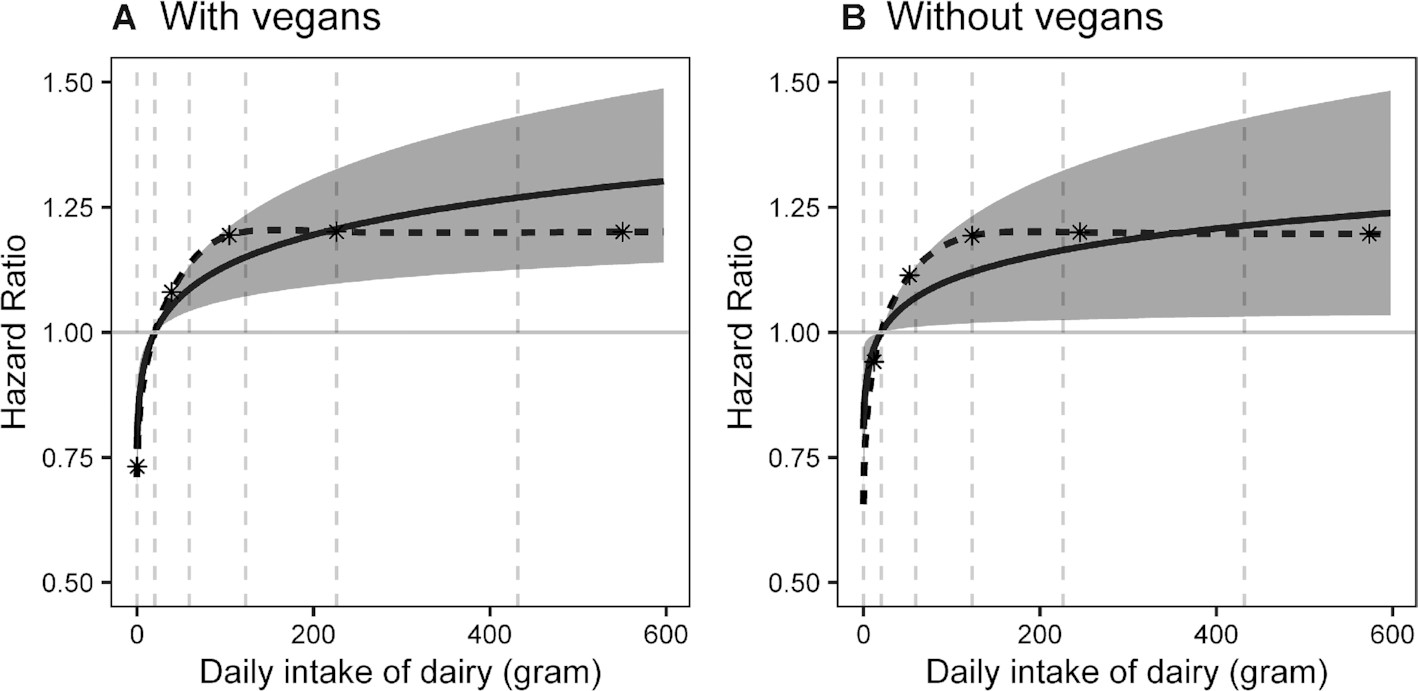 牛奶致癌又添新证?每天喝1.75杯牛奶,前列腺癌症风险增加27%!...
牛奶致癌又添新证?每天喝1.75杯牛奶,前列腺癌症风险增加27%!...
 饮食健康与前列腺癌
饮食健康与前列腺癌
 一种人人离不开的日用品,让前列腺癌5年生存率暴跌20%,免疫力大减!...
一种人人离不开的日用品,让前列腺癌5年生存率暴跌20%,免疫力大减!...
 警惕!腰围每增加10cm,前列腺癌死亡风险增加7%...
警惕!腰围每增加10cm,前列腺癌死亡风险增加7%...
其他热门专题








